L’horloge mécanique et la cellule ciliée vestibulaire
le 2 janvier 2014 | par Philippe Roi et Tristan GirardPar Philippe Roi(1), Tristan Girard(2), Alain Sans(3), Christian Chabbert(4)
(1)Chercheur en Sciences Cognitives, spécialisé en Archéologie Cognitive ; (2)Chercheur en Sciences Cognitives ; (3)Professeur Honoraire de Neurobiologie Sensorielle, INSERM, Université de Montpellier ; (4)Coordinateur de Recherches au CNRS, INSERM U1051, Institut des Neurosciences de Montpellier, Laboratoire de Physiologie et Thérapie des désordres vestibulaires.
Relecture : Joseph FLORES (Historien, Horloger, Rédacteur de la revue Horlogerie Ancienne, Membre de l’Association Française des Amateurs d’Horlogerie Ancienne), Enrique SOTO (Docteur en Science, Benemérita Universidad Autónoma de Puebla, Instituto de Fisiología), Michel LEIBOVICI (Docteur en Biologie Cellulaire et Moléculaire de l’Université Paris VI, Chercheur au CNRS, Institut Pasteur, puis Institut Cochin, INSERM U1016).
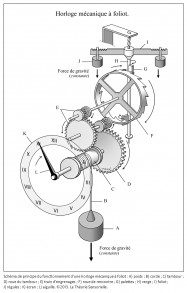
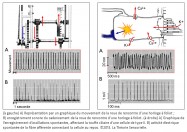
Inventée entre 1200 et 1300 de notre ère, l’horloge mécanique à foliot entraîne une transformation qualitative du concept de temps qui cesse d’être celui du gnomon, du cadran solaire, de la clepsydre et du sablier. Le gnomon dont l’origine remonte aux débuts de l’agriculture est un simple bâton planté dans le sol. En mesurant la longueur de l’ombre projetée par l’objet au cours de la journée, on peut étudier les mouvements apparents du soleil et en déduire les différents moments du jour. L’instrument postérieur au gnomon est le cadran solaire que l’on voit encore aujourd’hui sur les façades de quelques bâtiments. Inventé par les Mésopotamiens, il se compose d’un style et d’une base plane, sphérique ou cylindrique sur laquelle sont tracées des lignes marquant les subdivisions de la journée. Selon son degré de perfectionnement, le cadran solaire peut être un instrument très précis, il a le défaut cependant de ne pas fonctionner la nuit ou lorsque le ciel est couvert. Pour remédier à cet inconvénient, les Égyptiens inventent la clepsydre. Son nom vient du grec klepsydra, et servait à limiter le temps de parole des avocats lors des procès. C’est un instrument qui mesure le temps par l’écoulement d’une certaine quantité d’eau d’un récipient gradué dans un autre. L’avantage de la clepsydre est de s’affranchir du soleil, mais son inconvénient est de ne pas fonctionner pendant les hivers rigoureux des régions septentrionales, car l’eau gèle. Il faut donc inventer un nouvel instrument pour pallier ces faiblesses : ce sera le sablier. Il n’apparaît en Gaule qu’au 7e siècle, car sa fabrication exige tout le savoir-faire des maîtres verriers. L’écoulement du sable est en effet compromis s’il n’est pas protégé de l’humidité. Le sablier nécessite, en outre, d’être retourné plusieurs fois par jour. Il convient donc d’inventer un instrument fonctionnant de jour comme de nuit, qui ne gèle pas en hiver et qui ne réclame qu’un minimum de surveillance. Or, après avoir découvert avec le gnomon et le cadran solaire qu’on pouvait interpréter le déplacement du soleil dans l’espace comme une manifestation du temps, on s’est rendu compte que son écoulement traduit par un flux d’eau ou de sable pouvait être fractionné. Aussi, l’idée de partager le temps grâce à l’adoption d’un rythme régulier s’est peu à peu imposée avec la première horloge à foliot, à la fin du 13e siècle (1). Désormais, la mesure du temps ne dépend plus des éléments naturels ; c’est un temps mécanique, divisible en unités successives. L’invention de l’horloge à foliot est un événement historique d’une portée considérable, parce qu’il introduit la notion, pour le temps, de rythme séquentiel régulier. Il s’agit d’une révolution profonde, car cette invention exploite la force de gravité, en l’utilisant pour la première fois comme moteur et régulateur du système. Considérons le principe de fonctionnement de la première horloge mécanique à foliot : la chute d’un poids, relié par une corde à une poulie comportant un encliquetage, entraîne la rotation d’une roue verticale nommée roue de rencontre, dont le mouvement est régulé par un système dit d’échappement ; il en résulte des impulsions transmises à un train de rouages qui coordonne la rotation périodique d’une aiguille qui indique l’heure sur un cadran gradué. On pourrait croire que l’horloge mécanique n’est rien d’autre que la forme perfectionnée des clepsydres et des sabliers où la pesanteur sert aussi à mesurer le cours du temps, par écoulement de l’eau ou par glissement de sable ; mais il n’en est rien. La vitesse de chute du poids d’une horloge mécanique produit une accélération qui oblige les rouages à tourner de plus en plus vite et empêche le mouvement périodique du cadran. La solution consiste ici à cadencer et réguler, par un système alternatif de blocage-déblocage (nommé système d’échappement), le mouvement de la roue de rencontre et, à travers elle, la rotation du tambour et le dévidage de la corde qui retient le poids, afin qu’il s’effectue périodiquement. À cette fin, la roue de rencontre est munie de dents courbées qui agissent sur les palettes, elles-mêmes assujetties à une tige verticale appelée verge, sur laquelle est fixée une barre horizontale, le foliot. L’impulsion transmise par la roue de rencontre sur l’une des palettes de la verge initie le mouvement d’oscillation du foliot qui par retour grâce à l’inertie de ses régules – petits poids déplaçables fixés à ses extrémités – libère la roue de rencontre. Celle-ci, entraînée à nouveau par la chute du poids relâché, fournit alors une nouvelle impulsion sur l’autre palette, et ainsi de suite. Le mouvement cadencé qui en résulte est transmis par le train de rouages à l’aiguille selon un mouvement périodique (2).
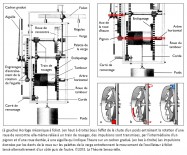
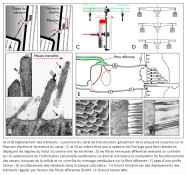
L’horloge mécanique à foliot étant décrite, comparons à présent son mécanisme avec celui d’une cellule ciliée de type II, au repos, de la macule sacculaire de l’appareil vestibulaire. Ce dernier, nous l’avons dit lors de l’analogie avec le métier à tisser vertical, a trois fonctions connues à ce jour : la première consiste à stabiliser la vision par les réflexes vestibulo-oculomoteurs ; la deuxième à orienter le corps en mouvement dans l’espace ; la troisième à assurer la perception du mouvement. Le vestibule se compose de trois canaux semi-circulaires, percevant les accélérations angulaires. Ils sont reliés par deux de leurs extrémités à l’utricule, sensible aux mouvements linéaires horizontaux, qui communique avec le saccule réceptif aux mouvements linéaires verticaux. Leurs épithéliums se composent de cellules sensorielles (de type I et de type II) dont les touffes ciliaires baignent dans l’endolymphe (3). La partie apicale de ces dernières est insérée dans une mince membrane protéique recouverte de cristaux de carbonate de calcium appelés otolithes ou otoconies.
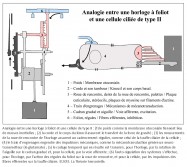
Une première comparaison peut être faite entre une horloge mécanique à foliot et une cellule ciliée de type II de la macule sacculaire – que nous avons choisie pour cette démonstration – concernant la gravitation. En effet, l’une comme l’autre la transforme en énergie motrice, puis la transfère pour alimenter une fonction annexe. Sur un plan structurel, plusieurs éléments peuvent être mis en parallèle de façon remarquable. Tout d’abord, le poids de l’horloge et la portion de membrane otoconiale au contact avec le kinocil de la cellule ciliée constituent des masses inertielles indispensables à la transformation de la force de gravité en énergie motrice (4). Ensuite, le transfert direct de cette énergie s’opère, dans les deux cas, de façon mécanique. Pour l’horloge, il s’effectue par le moyen d’une corde, enroulée autour d’un tambour, dont l’extrémité est rattachée à un poids ; pour la cellule sacculaire, il s’opère par l’intermédiaire du kinocil dont la partie apicale est enchâssée dans la membrane otoconiale, alors que la partie basale est solidaire de la cellule par une structure spéciale, le corps basal.
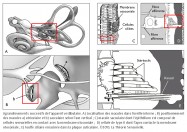
Une deuxième comparaison concerne le codage temporel. Pour l’horloge, il s’effectue par l’intermédiaire des dents de la roue de rencontre associées aux palettes de la verge – elle-même reliée à l’inertie des régules du foliot – qui ralentissent la chute du poids et induisent la périodicité du mouvement des engrenages, par une action de blocage-déblocage. Le foliot effectue ainsi un mouvement de va-et-vient sous forme d’oscillations rythmant le mouvement de rotation de la roue de rencontre de façon parfaitement régulière. De la même manière, il a été très récemment démontré que la touffe de stéréocils, enracinée dans la plaque cuticulaire – une structure rigide située à l’apex de la cellule et pourvue de filaments d’actine qui s’interconnectent de façon croisée avec les racines des stéréocils afin de les maintenir solidement fixés – était animée d’oscillations spontanées de l’ordre de 5 Hz, dont le résultat a pour effet l’ouverture et la fermeture alternées des canaux de mécanotransduction (5). Il s’ensuit que la transduction vestibulaire est remarquablement rapide, car elle ne passe pas par l’intermédiaire d’un médiateur chimique susceptible de la retarder. Elle survient en fait en quelques microsecondes – sachant qu’elle n’a pas de seuil de stimulation puisque l’enregistrement de vibrations est de l’ordre de 0,3 nm. Ces deux caractéristiques de la mécanotransduction, rapidité et absence de seuil, sont aussi rendues possibles par la propriété dite « d’adaptation » des canaux de transduction. En effet, la tension exercée sur les liens protéiques apicaux qui gouvernent l’ouverture et la fermeture des canaux de transduction se trouve relâchée suite à un glissement de la plaque de myosine sur son socle d’actine. Il se produit alors une fermeture automatique des « clapets » des stéréocils. C’est ainsi que les oscillations de la touffe ciliaire, amplifiées sous l’effet de la pesanteur par les micromouvements de la membrane otoconiale, provoquent in fine des dépolarisations de la cellule ciliée de type II. Celles-ci vont entraîner la libération cadencée d’un neuromédiateur, le glutamate, qui engendre sur la fibre nerveuse afférente des trains de potentiels d’action. Il en résulte, pour une cellule de type II au repos, un codage sensoriel dont le cadencement est étonnamment similaire au codage temporel effectué par une horloge à foliot. Ainsi, d’un point de vue fonctionnel, des comparaisons formelles existent entre le corps de la roue de rencontre et la plaque cuticulaire ; entre les dents de la roue de rencontre et les stéréocils enracinés dans la plaque cuticulaire ; entre les mouvements de blocage/déblocage des palettes de la verge et les mouvements de fermeture/ouverture des canaux de transduction et, enfin, entre le train de rouages qui engendre des impulsions mécaniques et la cellule sensorielle qui libère le neuromédiateur. Dans les deux cas, il en résulte un codage binaire de l’énergie motrice produite par le mouvement des masses inertielles, qu’il s’agisse du poids de l’horloge ou de la membrane otoconiale.
Une troisième comparaison concerne le réglage de la cadence du mouvement des palettes de la verge par les régules du foliot et le contrôle du cadencement de l’information sensorielle d’une cellule ciliée par les fibres efférentes. Les régules du foliot peuvent, en effet, être rapprochés ou éloignés du point de pivotement. Cela a pour effet de modifier – par le changement du rayon de giration – l’instant au cours duquel la verge oscille avec ses palettes, bloquant ou débloquant la roue de rencontre et, à travers elle, le mouvement de rotation initié par la chute du poids. Cette action, modulée par la position des régules, a pour but d’éviter le blocage ou l’emballement du système en maintenant la cadence à une vitesse constante. À l’instar des régules, les fibres nerveuses efférentes, qui se projettent depuis le tronc cérébral vers les cellules de la macule sacculaire, modulent le voltage de la cellule ciliée, entraînant la diminution ou l’augmentation de la libération de neuromédiateurs et donc une diminution ou une augmentation du rythme de potentiels d’action sur la fibre nerveuse afférente (6). Ainsi donc, au regard de cette analogie, il nous est permis d’envisager la possibilité que l’homme possède, à l’intérieur de l’oreille interne, une horloge vestibulaire.
NOTES
(1) Danese, B.; Oss, S. (2008) Dennis, M. (2010).
(2) Laviolette, J.G. (2003) Florès, J. (2009) Melguen, B. (2009).
(3) Alfon Rüsch, A. (1998).
(4) Sans, A. (2001)(2007).
(5) Martin, P. et al. (2003) Rutheford, A.M.; Roberts, M. (2009).
(6) Castellano-Mũnoz, M. et al. (2010).
BIBLIOGRAPHIE DE L’HORLOGE MÉCANIQUE À FOLIOT
Barnett, J.E., ‘The Mechanical Clock. The Machine.’ Time’s Pendulum: From Sundials to Atomic Clocks, the Fascinating History of Timekeeping and How Our Discoveries Changed the World. First Edition. Published by Harcourt Brace/Harvest Book (1999) pp. 62-73.
Bernstein, D.S., ‘Feedback control: an invisible thread in the history of technology.’ Control Systems Magazine. Vol. 22/2. Published by IEEE (2002) pp. 53-68.
Britten, F. J., The Watch and Clockmaker’s Handbook. Published by W. Kent & Co. (1881) pp. 56-58.
Bruton, E., ‘Domestic Clocks.’ The history of clocks and watches. Published by Chartwell Books, Inc. (2006) pp. 47-65.
Danese, B.; Oss, S., ‘A medieval clock made out of simple materials.’ European Journal of Physics. Vol. 29. Published by IOP (2008) pp. 799-814.
Dennis, M., ‘Verge and Foliot Clock Escapement: A Simple Dynamical System.’ The Physics Teacher. Vol. 48/6. Published by the American Association of Physics Teachers (2010) pp. 374-376.
Dohrn-van Rossum, G., ‘The Clock escapement.’ History of the Hour: Clocks and Modern Temporal Orders. Published by University Of Chicago Press (1998) pp. 48-51.
Feynman, R.P.; Leighton, R.B., Six Easy Pieces: Essentials of Physics Explained by Its Most Brilliant Teacher. Published by Basic Books (2011) pp. 112-114.
Florès, J., Perpétuelles à Roues de Rencontre. Publications de l’Association Française des Amateurs d’Horlogerie Ancienne – AFAHA (2009).
Gazely, W. J., Clock and Watch Escapements. Published by Robert Hale Ltd (1956).
Glasgow, D., Watch and Clock Making. Published by Cassel & Co (1885) pp. 137-154.
Gonord, A., Le Temps. Éditions Flammarion (2001).
Hart-Davis, A., ‘Le Livre du Temps.’ De la perception humaine à la mesure scientifique. Éditions Guy Trédaniel (2012).
Hart-Davis, A., The Book of Time: The Secrets of Time, How it Works and How We Measure It. Published by Firefly Books (2011).
Headrick, M. V., ‘Origin and evolution of the anchor clock escapement.’ Control Systems Magazine. Vol. 22 (2002) pp. 41-52.
Landes, D. S., Revolution in Time: Clocks and the Making of the Modern World. Published by Belknap Press of Harvard University Press (2000).
Laviolette, J.G., ‘Naissance de l’Horloge à Échappement Mécanique.’ Le Temps, ses Instruments de Mesure, leur Technique. Publication de l’Association Française des Amateurs d’Horlogerie Ancienne – AFAHA (2003) pp. 136-147.
Libet, B., Mind Time: The Temporal Factor in Consciousness. Published by Harvard University Press (2000).
Lloyd, A.H., ‘Mechanical Timekeepers.’ A History of Technology. Vol. 3. Edited by Charles Joseph Singer et al. Published by Clarendon Press (1957) pp. 648-675.
Melguen, B., La mesure du Temps. Éditions Apogée (2009).
Milham, W. I., Time & Timekeepers. Published by MacMillan (1923).
Penrose, R., ‘L’Etrange rôle du temps dans la perception consciente.’ L’Esprit, L’Ordinateur et les lois de la Physique. InterÉditions (1992) pp. 482-487.
Rawlings, A. L., The Science of Clocks and Watches. Published by The British Horological Institute (1993).
Roup, A .V.; Bernstein, D. S.; Nersesov, S. G.; Haddad, W. M.; Chellaboina, V., ‘Limit cycle analysis of the verge and foliot clock escapement using impulsive differential equations and Poincare maps.’ Proceeding of the American Control Conference 2001. Vol. 4. Published by IEEE (2001) pp. 3245-3250.
Roup, A.V.; Bernstein, D.S.; Nersevov, S.G.; Haddad, W.M., Challaboina, V., ‘Limit cycle analysis of the verge and foliot clock escapement using impulsive differential equations and Poincaré maps.’ International Journal of Control. Vol. 76/17. Published by Taylor & Francis (2003) pp. 1685-1698.
Scattergood, J., ‘Writing the clock: the reconstruction of time in the late Middle Ages.’ European Review. Vol. 11/04. Published by the Academia Europaea, Cambridge University Press (2003) pp. 453- 474.
Simrock, S., ‘Control Theory.’ Proceedings, CAS – Cern Accelerator School. Digitam Signal Processing. Sigtuna, Sweden 31 May – 9 June 2007. Brandt, D. (ed.) Published by Organisation Européenne pour la recherche nucléaire CERN – European Organization for Nuclear Research (2008) pp. 73-130.
Stoimenov, M.; Popkonstantinović, B.; Miladinović, L.; Petrović, D., ‘Evolution of Clock Escapement Mechanisms.’ FME Transactions. Vol. 40. Published by the Faculty of Mechanical Engineering (2012) pp. 17-23.
Trelat, E., Contrôle optimal – Théories et applications. Éditions Vuibert (2008).
Usher, A. P., A History of Mechanical Inventions. Chapter 7. Published by Havard University Press (1970).
Weinert, F., The March of Time: Evolving Conceptions of Time in the Light of Scientific Discoveries. Published by Springer (2013).
Whitrow, G.J., ‘The Advent of Mechanical Clock.’ Time in History: Views of Time from Prehistory to the Present Day. Published by Oxford University Press (1989) pp. 99-107.
BIBLIOGRAPHIE DE LA CELLULE CILIÉE VESTIBULAIRE
Alfons Rüsch, A.; Lysakowski,A.; Eatock, R.A., ‘Postnatal Development of Type I and Type II Hair Cells in the Mouse Utricle: Acquisition of Voltage-Gated Conductances and Differentiated Morphology.’ The Journal of Neuroscience. Vol. 18/18. Published by The Society for Neuroscience (1998) pp. 7487-7501.
Baird, R.A.; Desmadryl, G.; Fernandez, C.; Goldberg J. M., ‘The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals.’ The Journal of Physiology. Vol. 60/1. Published by Blackwell Publishing on behalf of the Physiological Society Published by the Physiological Society (1988) pp. 182-203.
Boyle, R.; Mesinger, A.F.; Yoshida, K.; Usui, S.; Intravaia, A.; Tricas, T.; Highstein, S., ‘Neural Readaptation to Earth’s Gravity Following Return From Space.’ Journal of Neurophysiology. Vol. 86. Published by The American Physiological Society (2001) pp. 2118-2122.
Brandt, T.; Schautzer, F.; Hamilton, D.A.; Brüning, R.; Markowitsch, H.J.; Kalla, R.; Darlington, C.; Smith, P.; Strupp, M., ‘Vestibular loss causes hippocampal atrophy and impaired spatial memory in humans.’ Brain. Vol. 128/11. Published by Oxford University Press (2005) pp. 2732-2741.
Brugeaud, A.; Travo, C.; Demêmes, D.; Lenoir, M.; Llorens, J.; Puel, J.-L.; Chabbert C., ‘Control of Hair Cell Excitability by Vestibular Primary Sensory Neurons.’ The Journal of Neuroscience. Vol. 27/13. Published by the Society for Neuroscience (2007) pp. 3503-3511.
Castellano-Muñoz, M.; Israel, S.A.; Hudspeth, A.J., ‘Efferent Control of the Electrical and Mechanical Properties of Hair Cells in the Bullfrog’s Sacculus.’ Plos One. Vol. 5/10. e13777. Plos One: www.plosone.org. Published online (2010) pp. 1-11.
Chan, Y.S.; Lai C.H.; Shum D.K.Y., ‘Bilateral Otolith Contribution to Spatial Coding in the Vestibular System.’ Journal of Biomedical Science. Vol. 9. Published by Springer (2002) pp. 574-586.
Demêmes, D.; Dechesne, C.J.; Venteo, S.; Gaven, F.; Raymond, J., ‘Development of the rat efferent vestibular system on the ground and in microgravity.’ Developmental Brain Research. Vol. 128. Published by Elsevier (2001) pp. 35-44.
DeRosier, D.J.; Tilney, L.G., ‘The Structure of the Cuticular Plate, an In Vivo Actin Gel.’ The Journal of Cell Biology. Volume 109/6 Pt. 1. Published by the Rockefeller University Press (1989) pp. 2853-2867.
Dutia, M.B.; Johnston, A.R.; McQueen, D.S., ‘Tonic activity of rat medial vestibular nucleus neurones in vitro and its inhibition by GABA.’ Experimental Brain Research. Vol. 88. Published by Springer (1992) pp. 466-472.
Flock, A.; Cheung, H.C., ‘Actin filaments in sensory hairs of inner ear receptor cells.’ Journal of Cell Biology. Published by the Rockefeller University Press. Vol. 75/2 (1977) pp. 339-343.
Flock, A.; Duvall, A.J., ‘The Ultrastructure of the Kinocilium of the Sensory Cells in the Inner Ear and Lateral Line organs.’ Journal of Cell Biology. Vol. 25/1. Published by the Rockefeller University Press (1965) pp. 1-8.
Fuller, P.M.; Jones, T.A.; Jones, S.M.; Fuller, C.A., ‘Evidence for Macular Gravity receptor Modulation of Hypothalamic, Limbic and Autonomic Nuclei.’ Neuroscience. Vol. 129. Published by Elsevier (2004) pp. 461-471.
Goldberg, J.M., ‘Afferent diversity and the organization of central vestibular pathways.’ Experimental Brain Research. Vol. 130/3. Published by Springer (2000) pp. 277-297.
Grant, W.; Best, W., ‘Otolith-organ mechanics: lumped parameter model and dynamic response.’ Aviation Space and Environmental Medicine. Vol. 58/10. Published by the Aerospace Medical Association (Alexandria 1987) pp. 970-976.
Harada Y.; Kasuga S.; Mori N., ‘The process of otoconia formation in guinea pig utricular supporting cells.’ Acta Otolaryngologia. Vol. 118/1. Published by Informa Healthcare (1998) pp. 74-79.
Hillman, D.E.; Lewis, E.R., ‘Morphological Basis for a Mechanical Linkage in Otholithic Receptor Transduction in the Frog.’ Science. Vol. 174. Published by AAAS (1971) pp. 416-419.
Holt, J.R.;. Corey D.P.; Eatock, R.A., ‘Mechanoelectrical Transduction and Adaptation in Hair Cells of the Mouse Utricle, a Low-Frequency Vestibular Organ.’ The Journal of Neuroscience. Vol. 17/22. Published by The Society for Neuroscience (1998), pp. 8739-8748.
Lai. C.H.; Chan, Y.S., ‘Development of the Vestibular System.’ Neuroembryology and Aging. Vol. 1. Published by Karger (2002) pp. 61-71.
Lapeyre, P.; Guilhaume, A.; Cazals, Y., ‘Differences in Hair Bundles Associated with Type I and Type II Vestibular Hair Cells of the Guinea Pig Saccule.’ Acta Otolaringologia. Vol. 112/2. Published by Informa Healthcare (1992) pp. 635-642.
Lins, U.; Farina, M.; Kurc, M.; Riordan, G.; Thalmann, R.; Thalmann, I.; Kachar,B., ‘The Otoconia of the Guinea Pig Utricle: Internal Structure, Surface Exposure, and Interactions with the Filament Matrix.’ Journal of Structural Biology. Vol. 131/1. Published by Elsevier (2000) pp. 67-78.
Lundberg, Y.W.; Zhao, X.; Yamoah, E.N., ‘Assembly of the otoconia complex to the macular sensory epithelium of the vestibule.’ Brain Research. Vol. 1091/1. Published by Elsevier (2006) pp. 47-57.
Lysakowski, A.; Goldberg, J.M., ‘Anatomy and Physiology of the Central and Péripheral Vestibular System: Overview.’ The Vestibular System. Stephen M. Highstein, Richard R. Fay and Arthur N. Popper (ed.) Published by Springer (2004) pp. 57-152.
Martin, P.; Bozovic, Y.; Hudspeth, A.J., ‘Spontaneous Oscillation by Hair Bundles of the Bullfrog’s Sacculus.’ The Journal of Neuroscience. Vol. 23/11. Published by The Society for Neuroscience (Washington 2003) pp. 4533-4548.
McAngus Todd,N.P.; Rosengren, S.M.; Colebatch, J.G., ‘Tuning and sensitivity of the human vestibular system to low-frequency vibration.’ Neuroscience Letters. Vol. 444. Published by Elsevier (Shannon 2008) pp. 36-41.
Naunton, R.F., The Vestibular System. Published by Academic Press (1975).
Petit, C.; Richardson, G.P., ‘Linking Deafness Genes to Hair-Bundle Development and Function.’ Nature Neuroscience. Vol. 12/6. Published by Nature Publishing Group (2009) pp. 703-710.
Rabbitt, R.D.; Damiano, E.R.; Grant, J.W., ‘Biomechanics of the Semicircular Canals and Otolith Organs.’ The Vestibular System. Stephen M. Highstein, Richard R. Fay and Arthur N. Popper (ed.) Published by Springer (2004) pp. 153-201.
Ricci, A.J.; Rennie, K.J.; Cochran, S.L.; Kevetter, G.A.; Correia, M.J., ‘Vestibular type I and type II hair cells. 1: Morphometric identification in the pigeon and gerbil.’ Journal of Vestibular Research: Equilibrium & Orientation. Vol. 7/5. Published by Pergamon Press (1997) pp. 393-406.
Rüsch, A.; Anna Lysakowski, A.; Eatock, R.A., ‘Postnatal Development of Type I and Type II Hair Cells in the Mouse Utricle: Acquisition of Voltage-Gated Conductances and Differentiated Morphology.’ The Journal of Neuroscience. Vol. 18/18. Published by The Society for Neuroscience (1998) pp. 7487-7501.
Rutheford, M.A.; Roberts, W.M., ‘Spikes and Membrane Potential Oscillations in Hair Cells Generate Periodic Afferent Activity in the Frog Sacculus.’ The Journal of Neuroscience. Vol. 29/32. Published by The Society for Neuroscience (2009) pp. 10025-10037.
Sans A., Dechesne, C. J.; Demêmes, D., ‘The Mammalian otolithic receptors: a complex morphological and biochemical organization.’ Otolith functions and disorders. Advances in oto-rhino-laryngology. Vol. 58. Published by Karger (2001) pp. 1-14.
Sans, A., ‘Le vertige positionnel paroxystique bénin. Apport de la recherche fondamentale.’ Bulletin de l’Académie des Sciences et Lettres de Montpellier. Vol. 39. Publication de l’Académie des Sciences de Montpellier (2008) pp. 103-110.
Sans, A.; Sauvage, J. P.; Chays, A.; Gentine, A., ‘Les Otoconies.’ Vertiges Positionnels. Rapport de la société française d’ORL et de chirurgie cervico-faciale (2007) pp. 63-70.
Wersäll, J.; Flock, Å.; Lundquist, P-G., ‘Structural Basis for Directional Sensitivity in Cochlear and Vestibular Sensory Receptors.’ Cold Spring Harbor Symposia on Quantitative Biology. Vol. 30. Published by Cold Spring Harbor Laboratory Press – CSHL Press (1965) pp. 115-132.
TABLE DES ILLUSTRATIONS
Photographie de la ‘page à la une’ : Philippe Roi et Tristan Girard, devant leur tableau de travail, au lendemain de la finalisation de l’analogie entre une horloge mécanique à foliot et une cellule de type II de l’appareil vestibulaire.
1) Girard, T. sous la direction de Florès, J. © 2013. La Théorie Sensorielle.
2) (à gauche) Berthoud, F. 1802. (en haut à droite) Berthoud, F. 1802(en bas à droite) Girard, T. sous la direction de Florès, J. © 2013. La Théorie Sensorielle.
3) Girard, T. sous la direction de Florès, J. et Sans, A. d’après une gravure de Berthoud, F. 1802. ©2013. La Théorie Sensorielle. © 2013. La Théorie Sensorielle.
4) A) Girard, T. d’après Leblanc, A. 1998. B) Girard, T. C) Girard, T. d’après Sans, A. et al. 2001. D) Girard, T. sous la direction de Sans, A. E) Girard, T. sous la direction de Sans, A. d’après Flock, A. et al. 1965. DeRosier, D.J. et Tilney, L.G. 1989. © 2013. La Théorie Sensorielle.
5) Analogie entre une horloge à foliot et une cellule ciliée type II. Roi, P. et Girard, T. © 2013. La Théorie Sensorielle.
6) A) Girard, T. sous la direction de Florès, J. B) Girard, T. Florès, J. A) Girard, T. d’après Martin, P. et al. 2003 et Sans, A. B) Girard, T. Sans, A. © 2013. La Théorie Sensorielle.
7) A) Girard, T. sous la dir. de Sans, A. d’après Hudspeth, A.J. 2000 et Nam, J-H. et al. 2007. B) Siemens, J. et al. 2004. C et D) Girard, T. sous la dir. de Florès, J. E) Girard, T. sous la dir. de Sans, A. F) Non connue. G) Image recomposée, infographie Girard, T. d’après DeRosier, D.J. et Tilney, L.G. 1989. H) Flock, A. et al. 1965. DeRosier, D.J. et Tilney, L.G. 1989. © 1965 Rockefeller University Press. Originally published in Journal of Cell Biology. 25:1-28. Avec l’aimable autorisation de l’éditeur. © 2013. La Théorie Sensorielle.
© 2013. La Théorie Sensorielle.